拡大する 2025年大阪・関西万博の大阪府市パビリオン総合プロデューサーも務める森下竜一さん=大阪府吹田市
2025年大阪・関西万博の大阪府市パビリオン総合プロデューサーも務める森下竜一さん=大阪府吹田市
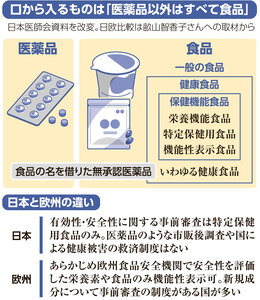
紅麴(こうじ)を使い機能性表示食品として届け出ていた小林製薬のサプリメントによる健康被害を受け、制度の見直しが進められている。2015年にスタートした機能性表示食品の制度そのものに問題はあったのか。今回の健康被害をどう捉えているか。「生みの親」である大阪大学の森下竜一・寄付講座教授に聞いた。
――機能性表示食品の発端は13年1月。当時の安倍晋三首相肝いりの規制改革会議の委員に森下さんが選ばれた。
当時、イメージによって売る「いわゆる健康食品」というあやしいものが多く出回っており、どんな成分が入り、どんな機能があるのか分からず、消費者が不利益を受けていた。
健康食品産業としては、食品の効果を宣伝に使うことはできなかった。トクホ(特定保健用食品)があるが、申請に多くの時間や費用がかかるので大手企業しか使えない状態。健康食品産業は、基本的に地方の中小企業が多い。地方経済の活性化のためにも何らかの施策が必要な状況だった。
ただ、規制改革のメインは、混合診療の解禁などで、機能性表示食品は規制改革の真ん中の案件ではなかった。
安倍さんの理解も大きかった
――森下さんが発案者なのか。
業界団体からの要望が大きかった。
医療費も増大する中、自らの健康を自らで守るセルフメディケーションを推進する流れもあり、議論がかみ合ってきた。
安倍さんの理解も大きかった。潰瘍(かいよう)性大腸炎を患っていた安倍さんは、サプリなどを予防的に使いたいという思いがあり、思い入れが強かった。断食など色々と試されていたようで、薬以外に頼る気持ちはよくわかる。ただ、具体的にこうしろという指示はなかった。
拡大する 第1回規制改革会議に出席した安倍晋三首相(当時)=2013年1月24日、首相官邸
第1回規制改革会議に出席した安倍晋三首相(当時)=2013年1月24日、首相官邸
――13年6月、安倍首相が「機能性表示を解禁する」とスピーチ。機能性表示食品の制度はわずか数カ月で決まった。
自民党は、政権を奪還して初めての国政選挙である参院選をその年の7月に控えていた。規制改革会議の方針はその前に出さなければいけなかった。
当時、機能性表示制度の最先端は米国だったが、米国は、ヒトではなく動物実験のデータも有効で、発売後の届け出でいい。そこで日本は安心安全のエビデンス(科学的根拠)を高めようと、ヒトの臨床試験を取り入れ、消費者や他の事業者がチェックできるようデータは販売前にサイトですべて開示し、届け出も事前制にした。表示が適正か事後チェックする制度も導入した。数カ月間でかなり議論をした。
健康への新しい解決策を提供できた
――大変だったのは。
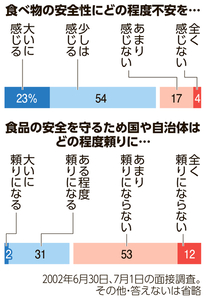
消費者側から安全性を指摘する厳しい声は多かった。
ただ、制度を厳しくしすぎると申請が進まずに「いわゆる健康食品」が残ってしまうし、緩くしすぎると何でもありとなる。
「消費者に被害が起きたら政府の責任だ」「安全性と有効性をどう担保するか」といったことを相当議論した。当初、消費者庁が審査して許可する案や、民間認証システムの案もあったが実現せず、届け出制になった。
――制度からまもなく10年。…